新型冠狀病毒進入細胞的結構機制和功能機制
新型冠狀病毒 (SARS-CoV-2 virus)
2019 年底爆發並迅速蔓延至全球多國的新冠肺炎疫情,是由新型冠狀病毒 (以下簡稱新冠病毒) 所引起的傳染病,根據基因分析,新冠病毒分類上屬於乙型冠狀病毒屬 (B beta-CoV lineage) [1, 2]。冠狀病毒為具有外套膜的正股單鏈 RNA 病毒,其特徵為病毒殼體表面的棒狀突起物和異常大的病毒 RNA 基因組。 新冠病毒的基因組會編碼出四種主要結構蛋白:刺突蛋白 (S)、包膜蛋白 (E)、膜蛋白 (M) 和核殼蛋白 (N),這些蛋白共同組成病毒顆粒結構 [3]。
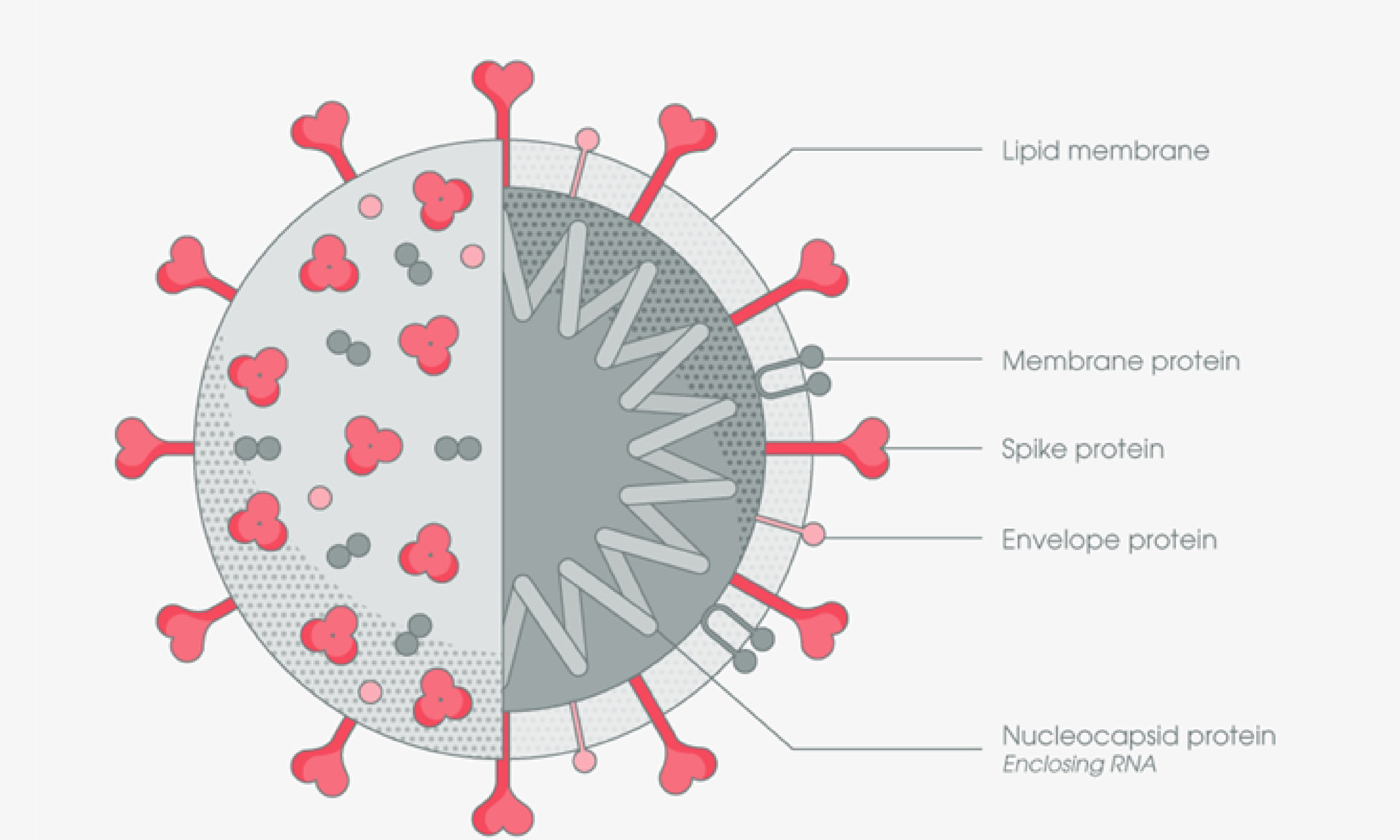
新型冠狀病毒與宿主細胞受體的結合
與所有冠狀病毒一樣,新冠病毒利用 S 蛋白質結合並進入宿主細胞。 S 蛋白質包含兩個次單元: S1 次單元和 S2 次單元。 S1 次單元包含一個受體結合區 (Receptor binding domain ; RBD),S2 次單元則參與病毒和宿主細胞膜融合的過程 [4]。
新冠病毒藉由 S 蛋白上的 RBD 區域與宿主細胞上的血管收縮素轉化酶 2(Angiotensin-converting enzyme 2,ACE2)結合, 結合後 S1 次單元會從病毒表面脫落,使 S2 次單元暴露出來並與宿主細胞膜融合。病毒與 ACE2 結合並進入宿主細胞的過程,還需要仰賴兩個重要的蛋白酶才可以完成,弗林蛋白酶 (Furin)和 TMPRSS2 蛋白酶,此兩種蛋白酶可分別在 S 蛋白的 S1/S2 和 S2' 位點進行切割,促進 S 蛋白活化。弗林蛋白酶切割 S1/S2 位點可能導致病毒 S 蛋白的 RBD 區域 和/或 S2 次單元發生結構改變。TMPRSS2 蛋白酶切割 S2' 位點,被認為能夠促使病毒殼體宿主細胞融合 [5, 6]。
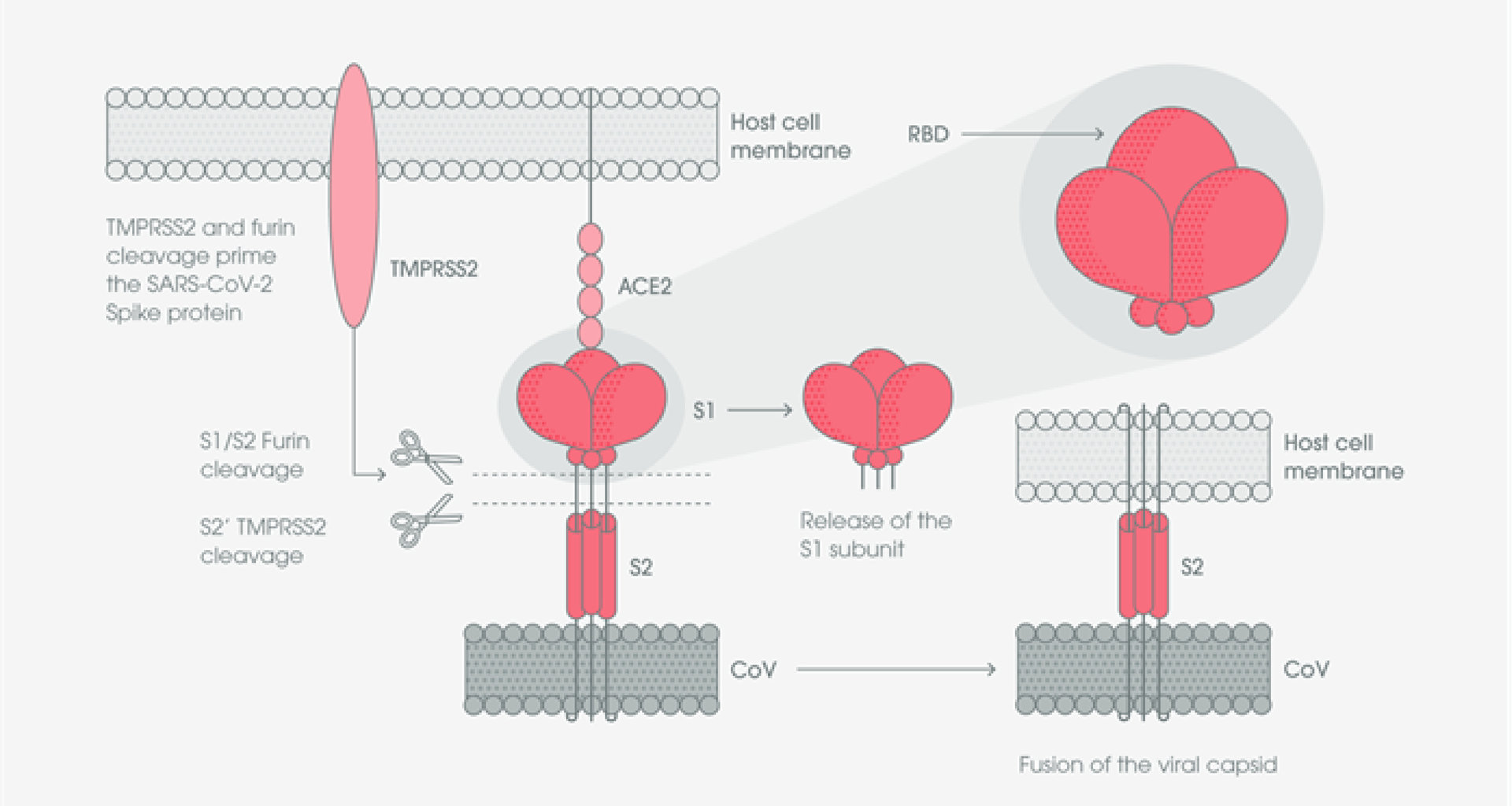
蛋白酶切割過程中, RBD 區域的暴露會使 S1 次單元成為不穩定的結構,因此病毒與宿主細胞結合過程中,S1 次單元會在兩種不同的結構之間進行轉換,稱為向上和向下結構。 向下結構會使得 RBD 區域隱沒,而向上結構雖會使 RBD 區域暴露出來,但也會暫時使得 S1 次單元處於結構不穩定的狀態 [7, 8, 9]。 在三聚體 S 蛋白的三個 RBD 中,只會有一個 RBD 的結構是處於可與 ACE2 宿主細胞受體結合的狀態 [10]。
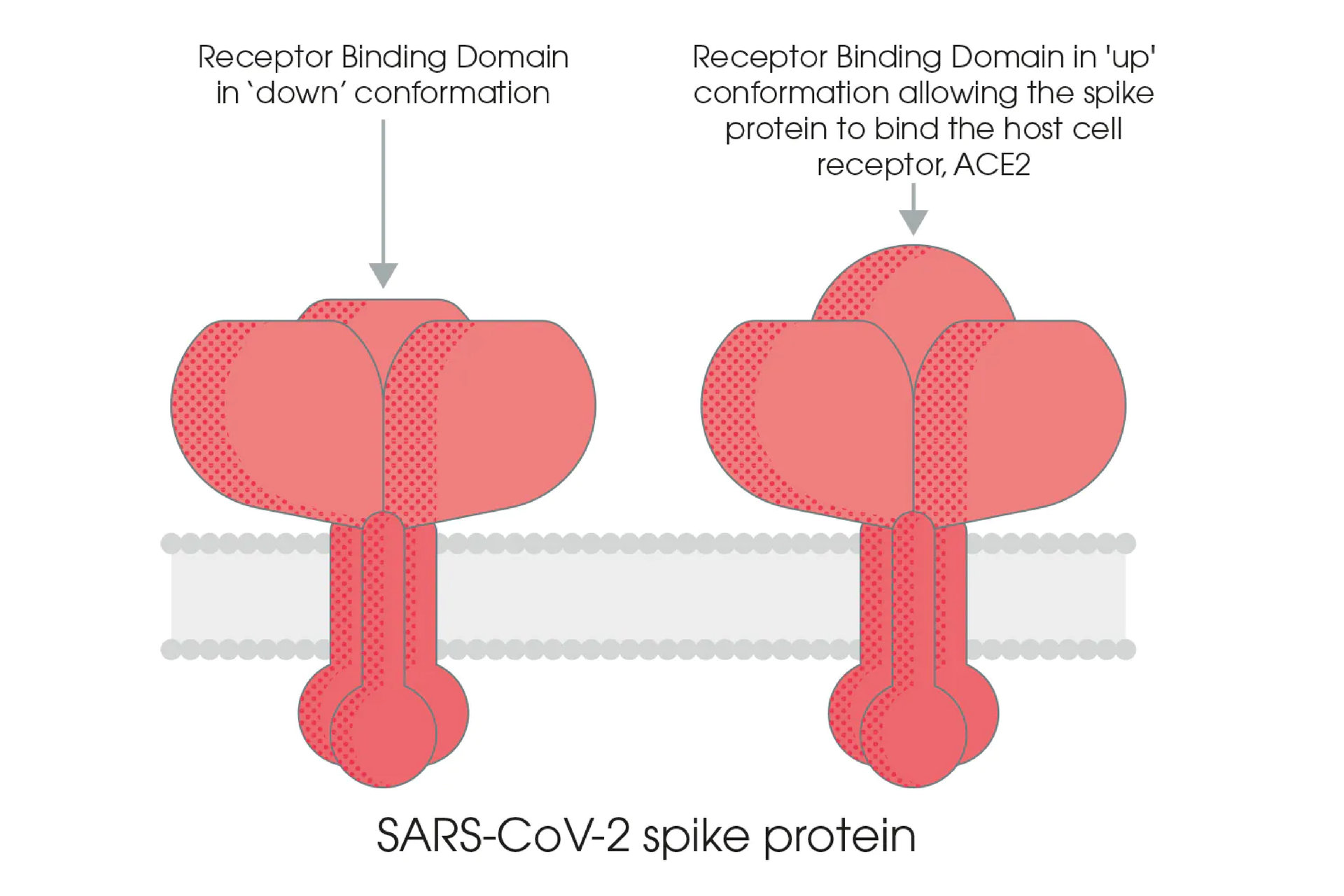
S 蛋白、ACE2、弗林蛋白酶和 TMPRSS2 蛋白酶,在病毒與宿主細胞結合並進入宿主細胞的步驟扮演著至關重要的角色,因此,這些蛋白質也成為了開發新冠病毒的藥物和病毒抑制劑的重要標靶。
新型冠狀病毒進入宿主細胞的替代機制
已有研究證據表明,除了與 ACE2 結合外,新冠病毒還可以藉由結合其他細胞表面分子以進入宿主細胞,允許新冠病毒進入宿主細胞的受體數量增加,也很好的解釋了新冠病毒與 SARS 病毒相比傳播性顯著增加的原因。
研究結果顯示,神經纖毛蛋白質 Neuropilin-1 和 Neuropilin-2 均可以與蛋白酶切割過的 S 蛋白結合,並介導病毒進入宿主細胞 [11, 12]。NP 蛋白在神經元中表達,為病毒進入神經系統提供捷徑,在死亡患者的病理解剖中,也有觀察到神經系統的感染 [12]。
抗體阻斷、受體誘變和結構研究等研究結果均支持 NP 作為新冠病毒 S 蛋白的細胞受體除了已知的 ACE2 受體外,與細胞表面 NP 受體的結合,可增強新冠病毒感染細胞的能力,並且可能解釋了與 SARS病毒感染相比,新冠病毒感染的組織趨向性增加的原因 [11, 12]。
一項初步研究表明,新冠病毒 S 蛋白能夠與細胞表面的 CD147 結合以進入宿主細胞 [13]。體外抗病毒測試表明,Meplazumab (一種抗 CD147 人源化抗體) 阻斷了 S 蛋白與 CD147 細胞表面受體的相互作用,顯著抑制病毒進入宿主細胞。 目前,使用 Meplazumab 作為新冠肺炎藥物的臨床試驗正在進行中 [14]。由於已知較高的血糖會促使 CD147 表達量增加,這可能有助於解釋為什麼糖尿病是新冠肺炎病例預後不良的因素之一 [15]。
新冠病毒常見的標靶細胞是神經元細胞、血管內皮細胞以及呼吸系統和胃腸道內的上皮細胞 [16]。然而,已知 ACE2 在人類腦細胞中低度表達 [17],因此,應存在其他受體使得新冠病毒可以進入神經元細胞。一項結構模型研究表明,新冠病毒可以與細胞表面的唾液酸糖蛋白 (Sialic acid glycoproteins) 和神經節苷脂結合 (Gangliosides) [18],唾液酸在所有新冠病毒可感染的細胞類型中高度表達 [19],包括神經元細胞。與唾液酸受體結合也是其他病毒常見的進入細胞機制,包括流感病毒 [20]、MERS 病毒、SARS 病毒和 HCoV-OC43 病毒 [21],使用藥物降低新冠肺炎患者的唾液酸水平,以幫助預防 新冠病毒進入細胞,提供了一個潛在的新治療策略 [22]。
Abcam 新冠病毒相關產品推薦
| Name | AbID | Application |
| Anti-SARS-CoV-2 Spike Glycoprotein S1 antibody [CR3022] | ab273073 | Neutralising, ELISA |
| Recombinant Anti-SARS-CoV-2 Spike Glycoprotein S1 antibody [CR3022] - Chimeric | ab273074 | Neutralising, ELISA |
| Anti-SARS spike glycoprotein antibody [1A9] | ab273433 | ELISA, WB, ICC/IF, Flow Cyt, IP |
| Anti-SARS nucleocapsid protein antibody [6H3] | ab273434 | ELISA, WB, ICC/IF, Flow Cyt, IP |
| Recombinant Human coronavirus SARS-CoV-2 nucleocapsid protein (His tag) | ab273530 | ELISA, WB |
| Human ACE2 ELISA Kit | ab235649 | ELISA |
| Recombinant Anti-ACE2 antibody [EPR4435(2)] | ab108252 | IHC-P, IP, WB |
| Anti-ACE2 antibody [EPR4436] | ab108209 | WB, IP, IHC-P |
| Recombinant Human ACE2 protein (Fc chimera) | ab273687 | WB, ELISA, HPLC |
Recombinant Human ACE2 (mutated H374 N + H378 N) protein (Fc Chimera) | ab273885 | WB, ELISA, HPLC |
| Recombinant Anti-TMPRSS2 antibody [EPR3862] | ab109131 | ICC/IF, WB, IHC-P |
| Recombinant anti-TMPRSS2 antibody [EPR3861] | ab92323 | WB, IHC-P |
| DX600 ACE2 inhibitor | ab273525 | Inhibitor |
| Camostat mesylate, TMPRSS2 inhibitor | ab145709 | Inhibitor |
| Recombinant Anti-Furin antibody [EPR14674] | ab183495 | ICC/IF, IHC-P, WB |
| Naphthofluorescein, Furin inhibitor | ab145383 | Inhibitor |
| Recombinant Anti-Neuropilin 1 antibody [EPR3113] | ab81321 | ICC/IF, Flow Cyt, IP, IHC-P, WB |
| Recombinant anti-CD147 antibody [EPR4053] | ab108308 | ICC/IF, IHC-P, WB |
| Recombinant Anti-SARS nucleocapsid protein antibody [CR-3018 (03-018] | ab275983 | ELISA |
| Recombinant Anti-SARS nucleocapsid protein antibody [CR-3009 (03-009)] | ab275984 | E |
更多產品資訊歡迎與 abcam 台灣代理—昶安生技洽詢。您可透過下方連結瀏覽相關訊息
References
- Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, 270–273 (2020).
- Wu F, Zhao S, Yu B, et al. A new coronavirus associated with human respiratory disease in China. Nature 579, 265–269 (2020).
- Fehr AR and Perlman S. Coronaviruses: an overview of their replication and pathogenesis. Methods Mol Biol. 1282:1-23 (2015).
- Walls AC, Park YJ, Tortorici MA, et al. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell 181(2), 281-292.e6 (2020).
- Bestle D, Heindl MR, Limbu H et al. TMPRSS2 and furin are both essential for proteolytic activation and spread of SARS-CoV-2 in human airway epithelial cells and provide promising drug targets. bioRxiv doi: https://doi.org/10.1101/2020.04.15.042085 (2020).
- Yuan M, Wu MC, Zhu X, et al. A highly conserved cryptic epitope in the receptor-binding domains of SARS-CoV-2 and SARS-CoV. Science 10.1126/science.abb7269 (2020).
- Gui M, Song W, Zhou H, et al. Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding. Cell Res. 27, 119–129 (2017).
- Walls AC, Xiong X, Park YJ, et al. Unexpected receptor functional mimicry elucidates activation of coronavirus fusion. Cell 176, 1026–1039.e15 (2019).
- Walls AC, Tortorici MA, Snijder J, et al. Tectonic conformational changes of a coronavirus spike glycoprotein promote membrane fusion. Proc. Natl. Acad. Sci. U.S.A. 114, 11157–11162 (2017).
- Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 36(6483), 1260-1263 (2020).
- Daly et al. Neuropilin-1 is a host factor for SARS-CoV-2 infection. bioRxiv doi:10.1101/2020.06.05.134114
- Cantuti-Castelvetri et al. Neuropilin-1 facilitates SARS-CoV-2 cell entry and provides a possible pathway into the central nervous system. bioRxiv. doi:10.1101/2020.06.07.137802
- Wang et al. SARS-CoV-2 invades host cells via a novel route: CD147-spike protein. bioRxiv. [doi:10.1101/2020.03.14988345]
- Clinicaltrials.gov Clinical Study of Anti-CD147 Humanized Meplazumab for Injection to Treat With 2019-nCoV Pneumonia [Accessed: 21/07/2020]
- Bao et al. Monocyte CD147 is induced by advanced glycation end products and high glucose concentration: possible role in diabetic complications. Am J Physiol Cell Physiol 299(5):C1212-9. (2010).
- Zhang et al. New understanding of the damage of SARS-CoV-2 infection outside the respiratory system. Biomed Pharmacother. 127: 110195 (2020).
- Alenina M and Bader M. ACE2 in Brain Physiology and Pathophysiology: Evidence from Transgenic Animal Models. Neurochem Res 44(6):1323-1329 (2019).
- Fantini et al. Structural and molecular modelling studies reveal a new mechanism of action of chloroquine and hydroxychloroquine against SARS-CoV-2 infection. Int J Antimicorb Agents 55(5):105960 (2020).
- Roe K. High COVID‐19 virus replication rates, the creation of antigen–antibody immune complexes and indirect haemagglutination resulting in thrombosis. Transbound Emerg Dis. 67(4):1418-1421 (2020).
- Yang et al. Mutations during the Adaptation of H9N2 Avian Influenza Virus to the Respiratory Epithelium of Pigs Enhance Sialic Acid Binding Activity and Virulence in Mice. J Virol. 91(8): e02125-16 (2017).
- Devaux et al. New insights on the antiviral effects of chloroquine against coronavirus: what to expect for COVID-19? Int J Antimicorb Agents 55(5):105938 (2020).Li et al. Identification of sialic acid-binding function for the Middle East respiratory syndrome coronavirus spike glycoprotein. PNAS. 114(40) E8508-E8517 (2017).
- Li et al. Identification of sialic acid-binding function for the Middle East respiratory syndrome coronavirus spike glycoprotein. PNAS. 114(40) E8508-E8517 (2017).